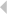-
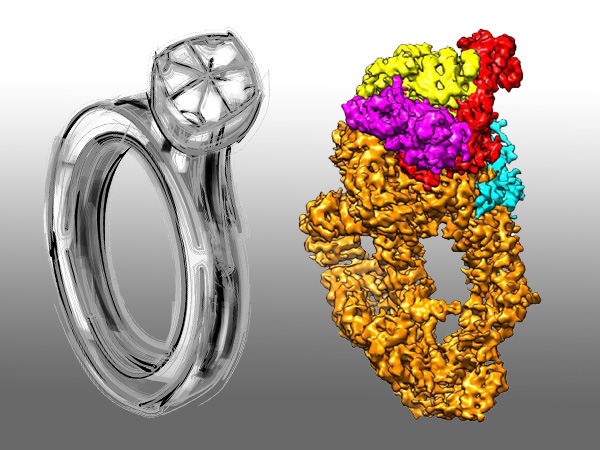
中青在线讯(范琼 中国青年报·中青在线记者 王磊) 钻戒可以增进两个爱人之间的感情,具有“钻戒”结构的组蛋白乙酰转移酶/反式激活蛋白结合蛋白复合物(下称该复合物)能促进生物体内多种重要过程,包括转录、DNA损伤修复和信号传导等。中国科学技术大学蔡刚教授课题组和加拿大拉瓦尔大学癌症研究中心雅克·科特教授课题组合作研究,实现了对酿酒酵母中该乙酰转移酶结构的高精度描绘,揭示了组装和调控的机制,并描绘了组分间的相互作用界面。相关成果于3月20日发表在《自然·通讯》上。该复合物是一种调控真核细胞基因组稳定性的重要乙酰转移酶。受限于其组成的复杂性和构象的多变性,传统的分析手段难以达到足够的精度,学界对这种复合物组装和调控机制的研究难以取得突破。蔡刚教授课题组利用冷冻电镜,获得了该复合物在亚纳米分辨率的精细三维结构,并清晰展现出它组装的过程和调节界面。
研究发现,在该复合物的组装中起到重要作用的一个化合物,也被称为“假激酶”的,并不具备激酶活性,但能在复合体中采取类似激活态激酶的构象,与另一组分一起构成了该复合体组装的支架,引导蛋白质的组装。同时,这个假激酶的作用机制表明,同家族其他成员很可能具有独立于激酶活性外的“脚手架”功能。
另一个重要发现是,与癌症直接相关的这一假激酶的突变都聚集在复合物的组装界面上,该界面同时是受多种修饰调控的热点。这表明该复合体的组装及其精细调控具有重要的生理意义,有助于我们进一步了解相关癌症发生的机制并精准确定标志物。
在几种多发癌症中,该复合物受到显著下调。因此可利用特异性的抑制剂针对癌细胞进行治疗。未来,蔡刚课题组将着力于解析全酶复合物的高分辨率结构及其底物选择性和催化的机理,借此帮助特异性抑制剂的研发,有望为癌症的个性化治疗带来重大突破。
【责任编辑:齐琪】 -
相关文章
- [ 02-13 ]
- [ 01-10 ]
- [ 12-15 ]
- [ 12-14 ]
- [ 12-09 ]
- 热点新闻更多>>
-
- [ 03-21 ]
- [ 03-21 ]
- [ 03-21 ]
- [ 03-21 ]
- [ 03-20 ]
- [ 03-20 ]
- [ 03-20 ]
- [ 03-19 ]
- [ 03-20 ]
- [ 03-20 ]